Duseck Brutus, Reginald
Pirla Santiburcio, Natalia
Gil Camargo, Vanesa
EPIDEMIOLOGÍA
El traumatismo craneoencefálico (TCE) supone una patología muy frecuente en los servicios de urgencias hospitalarias a nivel mundial, constituyendo un auténtico problema de salud pública por su elevada morbimortalidad y coste.
En España, la incidencia anual de TCE es de aproximadamente 200/100.000 habitantes. De ellos el 70% presenta una buena recuperación, el 9% fallecen antes de llegar al hospital, el 6% lo hace durante su estancia hospitalaria y el 15% restante queda discapacitado de alguna forma.
El TCE afecta principalmente a los adolescentes, adultos jóvenes y ancianos de más de 75 años. Siendo el mecanismo fundamental los accidentes de tráfico (73%) en el primer grupo y las caídas (20%) en el segundo. En los ancianos de más de 75 años, ha sido calificada como la “epidemia silente” por The Centers for Disease Control and Prevention.
CONCEPTO Y CLASIFICACIÓN
El TCE se define como una lesión heterogénea producida por un impacto súbito que involucra un intercambio de energía mecánica entre el cráneo y una superficie.
Se clasifica fundamentalmente EN BASE AL GRADO DE NIVEL DE CONSCIENCIA y función neurológica del individuo siguiendo la Escala de Coma de Glasgow. Podemos decir que un 75% de los TCE son leves, un 15% moderados y un 10% graves.
| GRAVEDAD | GCS |
| LEVE | GCS 14 – 15 |
| MODERADO | GCS 13 – 9 |
| GRAVE | GCS 8 o menor |
Escala Glasgow: comprobar lesiones asociadas que puedan interferir en la evaluación, observamos las respuestas del paciente sin aplicar estímulo, tras aplicar estímulo verbal y físico. Calificamos con la mejor respuesta obtenida.
| RESPUESTA MOTORA | ||
| OBEDECE ÓRDENES | Obedece órdenes sencillas | 6 |
| LOCALIZA | Lleva mano por encima clavícula con estímulo doloroso en cabeza y cuello | 5 |
| RESPUESTA FLEXORA NORMAL O DE RETIRADA | Retira el miembro superior flexionando el codo de forma rápida y apartándolo del torso con estímulo doloroso en el dedo. | 4 |
| RESPUESTA FLEXORA ANÓMALA (DECORTICACIÓN) | Flexiona el codo de forma lenta sobre el torso rotando el antebrazo con estímulo doloroso en el dedo | 3 |
| RESPUESTA EXTENSORA (DESCEREBRACIÓN) | Extiende el codo con rotación interna de todo el miembro superior | 2 |
| AUSENCIA DE RESPUESTA MOTORA | No realiza ningún movimiento ante el estímulo doloroso. | 1 |
| NO VALORABLE | Existen factores que impiden la evaluación de la respuesta | N/V |
| RESPUESTA VERBAL | ||
| ORIENTADO | Nombre, lugar y fecha | 5 |
| LENGUAJE COHERENTE | Desorientado pero con discurso coherente | 4 |
| LENGUAJE INTELIGIBLE | Palabras inteligibles en discurso incoherente | 3 |
| SONIDOS ININTELIGIBLES | Emite sonido no palabras ante estimulo doloroso | 2 |
| AUSENCIA DE LENGUAJE VERBAL | Ausencia de sonidos | 1 |
| NO VALORABLE | Existen factores que impiden la evaluación de la respuesta | N/V |
| RESPUESTA OCULAR | ||
| APERTURA OCULAR ESPONTÁNEA | Ojos abiertos sin necesidad de estímulo | 4 |
| APERTURA A LA LLAMADA | Abre los ojos cuando se le dice verbalmente | 3 |
| APERTURA AL DOLOR | Abre los ojos cuando se aplica estímulo doloroso | 2 |
| AUSENCIA DE APERTURA OCULAR | No abre ante ningún estímulo | 1 |
| NO VALORABLE | Existen factores que impiden la evaluación de la respuesta | N/V |
También podemos utilizar la Escala Tomográfica de Marshall, BASADA EN LOS RESULTADOS DE LA TOMOGRAFÍA COMPUTERIZADA de cráneo y encéfalo identificando la presencia o ausencia de daño estructural y el patrón de lesión cerebral. Las lesiones tipo IV y VI son las más relacionadas con mal pronóstico.
| TIPO | DESCRIPCIÓN | MORTALIDAD | |
| Lesión difusa tipo I | Sin hallazgos de lesión intracraneal | 10% | 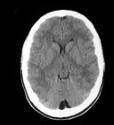 |
| Lesión difusa tipo II | Desviación de línea media de 0-5 mm, cisternas basales patentes, no hay focos de sangrado > 25 cm3 | 14% | 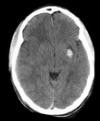 |
| Lesión difusa tipo III (swelling) | Desviación de línea media de 0-5 mm, cisternas basales ausentes, no hay focos de sangrado >25 cm3 | 34% | 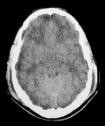 |
| Lesión difusa tipo IV
(shift) |
Desviación de línea media de >5 mm, cisternas basales ausentes, no hay focos de sangrado mayores de 25 cm3 | 56% |  |
| Lesión tipo masa no evacuada (sangrado >25 cm3) | 65,2% | 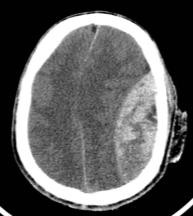 |
|
| Lesión tipo masa evacuada | 84.6% | 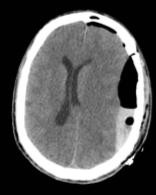 |
Las lesiones originadas se superponen en el tiempo y pueden ser clasificadas EN BASE A SU VERTIENTE ETIOPATOGENIA en lesiones primarias y lesiones secundarias.
| LESIONES PRIMARIAS | LESIONES SECUNDARIAS | |
| Tipo de lesiones | Fracturas, contusiones, laceraciones y la lesión axonal difusa. | Hematomas y hemorragias intracraneales, el edema y las lesiones isquémicas. |
| Mecanismo lesional | Impacto, aceleración y desaceleración. | Se inician en momento del impacto. |
| Manifestación clínica | De forma inmediata al traumatismo. | Manifestación clínica más tardía. |
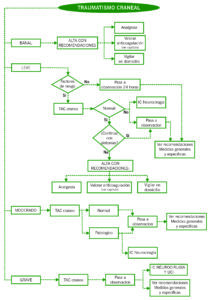
DIAGNÓSTICO Y MANEJO DEL TCE LEVE/MODERADO
El triage del paciente con TCE depende de la severidad del daño y de la disponibilidad de instalaciones adecuadas en una comunidad dada. Las instituciones que no cuenten con cobertura neuroquirúrgica deben tener convenios de traslado preestablecidos con instituciones de más alto nivel, para el traslado de aquellos pacientes que lo precisen.
- Un TCE leve es aquel que presenta una GCS de 13 a 15 con alguno de los siguientes síntomas: cefalea persistente generalizada, vómitos repetidos, amnesia anterógrada o retrógrada o pérdida de consciencia.
- Si existe una GCS de 15 y ninguno de estos síntomas nos encontramos ante una contusión craneal sin constituir un verdadero TCE.
- La NOC (New Orleans Criteria) y la CCTHR (Canadian CT Head Rule) establecen una serie de criterios que dividen en mayores y menores, se debe de aplicar a los TCE leve independientemente de si presentan pérdida de conocimiento o amnesia postraumática. Cumpliendo uno de los diez criterios mayores o dos de los criterios menores se ha obtenido una sensibilidad del 94-96% y especificidad del 25- 32% para identificar lesiones intracraneales.
| Ia | Ib | Ic | II | III | |
| GCS | 15 | 15 | 14 | 9-13 | <9 |
|
PRESENTA AL MENOS 1 DE LAS SIGUIENTES |
|||||
| PERDIDA CONCIENCIA | NO | SI | … | … | … |
| AMNESIA | NO | SI | … | … | … |
| CEFALEA | NO | SI | … | … | … |
| VOMITOS | NO | SI | … | … | … |
| DESORIENTACION | NO | NO | SI | … | … |
| AGITACION | NO | NO | SI | … | … |
| FACTORES RIESGO | NO | NO | SI* | … | … |
| CONVULSION | NO | NO | NO | SI | … |
| FOCALIDAD | NO | NO | NO | SI | … |
|
PRUEBAS COMPLEMENTARIAS A REALIZAR |
|||||
| RX CRANEO | SI | SI | NO | NO | NO |
| TAC | NO | NO | SI | SI | SI |
| INTERCONSULTA NC | NO | NO | SI LH(1) | SI LH(1) | SI LH(1) |
|
DERIVACIÓN DEL PACIENTE |
|||||
| ALTA DOMICILIO | SI | NO | SI TC NORMAL | NO | NO |
| OBSERVACION | NO | SI | SI LH(1) | SI | NO |
| UCI | NO | NO | NO | SI LOE | SI |
* Pacientes Ib con al menos un factor de riesgo:
- Signos clínicos de Fractura craneal.
- Edad>65 años, sólo si están antiagregados.
- Derivación Ventriculo-Peritoneal.
(Adaptación a Guías 2013 del Comité de Neurotrauma Escandinavo BMC Medicine 2013, 11:50. Disponible en: http://www.biomedcentral.com/1741-7015/11/50)
(1) LH: Lesión Hemorrágica
- Siempre que haya una TC patológica hay que ingresar al paciente en observación como mínimo 24 horas y considerar interconsulta con neurocirugía. Habrá que repetir la TC si se deteriora neurológicamente o baja la escala GCS en dos o más puntos.
- A partir del GCS de 13 la TC es obligado siempre.
ALGORITMO DE MANEJO DEL TRAUMATISMO CRANEAL
TRATAMIENTO MÉDICO DEL TCE LEVE O MODERADO EN OBSERVACIÓN DEL SERVICIO DE URGENCIAS
MEDIDAS GENERALES
- Ubicación del paciente en unidad de observación monitorizada.
- Reposo en cama con cabecero a 30º.
- Monitorización básica: EKG continuo, FC, SpO2, TA horaria, temperatura horaria.
- Vigilancia neurológica estrecha: reactividad pupilar y GCS cada hora.
- Dieta absoluta.
MEDIDAS ESPECÍFICAS
- Analgesia intravenosa según EVA. Se utilizarán preferentemente Paracetamol, Metamizol, cloruro mórfico o fentanilo, salvo alergia o contraindicación formal. Se evitarán AINEs.
- Sueroterapia con suero salino fisiológico 30 ml/kg/día. Se realizarán las correcciones de volumen oportunas en aquellos pacientes con patología cardiaca o renal que requieran restricción de volumen.
- Protección gástrica con IBP (Omeprazol, Pantoprazol) a dosis habituales.
- Suspensión inmediata de medicación antiagregante o anticoagulante. En aquellos pacientes que realicen tratamiento con anticoagulantes orales (Dabigatrán, Apixabán, Ribaroxabán, Aldocumar, Acenocumarol) se procederá a la reversión de su efecto si procede (ver capitulo Anticoagulación).
- Antiepilépticos: La epilepsia postraumática aparece en un 5% de los pacientes que ingresa por TCE cerrado y se clasifica en temprana si ocurre en los primeros 7 días postraumatismo; o tardía si aparece después. A su vez, las crisis tempranas pueden clasificarse en inmediatas (si ocurren a los 5, 10, 60 minutos o incluso en las primeras 24 horas), o diferidas (si ocurren entre las 24 horas y la primera semana).
- Las crisis postraumáticas inmediatas que se expresan generalmente como crisis de tipo generalizadas, tónicas e hipotónicas carecen de valor pronóstico para la aparición con posterioridad de una Epilepsia Postraumática.
- Las crisis epilépticas diferidas se correlacionan con la severidad de distribución del daño cerebral. La presentación de crisis en la primera semana tras sufrir el TCE multiplica por ocho veces el riesgo de sufrir una epilepsia tardía.
Se iniciará tratamiento con Levetiracetam 1000 mg cada 12 horas en aquellos pacientes con TCE leve o moderado que hayan presentado crisis comiciales. No existe evidencia científica que apoye el uso de antiepilépticos de forma profiláctica en el TCE leve-moderado. Sí existe en el TCE grave, para disminuir las crisis tempranas, con igualdad de eficacia para Levetiracetam y Fenitoína, prefiriendo el primero por mejor perfil de seguridad.
- Corticoides: no existe evidencia científica que apoye el uso de corticoides en el TCE, cualquiera que sea su gravedad. En el TCE grave su uso está contraindicado (recomendación clase I, nivel A).
MANEJO DEL TCE GRAVE
El principal objetivo en el tratamiento de pacientes con sospecha de TCE es prevenir la lesión cerebral secundaria. Proveer una oxigenación adecuada y mantener una presión sanguínea suficiente para perfundir el cerebro son los medios más importantes para limitar la lesión cerebral secundaria y, por tanto, mejorar el pronóstico del paciente. Después de manejar el ABCDE, es prioritario identificar lesiones con efecto masa que requieran evacuación quirúrgica mediante TC.
| A. B. VÍA AÉREA Y VENTILACIÓN | – GSC<9 IOT
– Perseguir una saturación de oxígeno mayor o igual al 95% con una PaCO2 entre 35 y 40 mmHg – Una PEEP entre 5-8 cm H2O mantiene una adecuada oxigenación y previene el colapso pulmonar. – La hiperventilación solo se recomienda durante un periodo corto de tiempo para reducir la presión intracraneal (15-30 minutos)*1. |
| C. CIRCULACIÓN | – La hemorragia intracraneal NO puede producir shock hemorrágico. Solo hipotensión en lesiones terminales con daño bulbo raquídeo o lesión espinal.*2
– Debe existir una presión arterial mínima que se ha fijado en 90mmHg de presión arterial media. – Se recomienda reanimación con líquidos isotónico NaCl 0,9%, no hipotónicos ni glucosados en primeras 24 h salvo hipoglucemia. – Mantener la PVC entre 8-10 mmHg. – Mantener una Hb de más de 100 g/L, un Hcto por encima de 0,3 y debemos un recuento plaquetario por encima de 100.000 plaquetas. – Monitorizar la terapia hemostática mediante tests viscoelásticos (pej ROTEM) en TCE grave por sangrados y coagulopatía. |
| D. DÉFICIT NEUROLÓGICO
|
– No atribuir alteraciones del estado mental a factores que puedan causar confusión (consumo de tóxicos o alcohol) hasta haber sido excluida definitivamente la lesión cerebral.
– Si tenemos un aumento de PIC establecido o un deterioro neurológico agudo hay que tratarlo desde el momento en el que se constate. Aumento de PIC: Manitol: Se administrará entre 0,25-1 g/Kg IV en un periodo de 15-20 minutos. Puede provocar hipotensión. – Terapia hiperosmolar: Consiste en NaCl 7,5%: 2mL/Kg IV en unos 15 minutos, pudiendo repetirlo si la osmolaridad sanguínea es menor de 320mOSm/Kg. |
| E. EXPOSICIÓN TOTAL Y REEVALUACIÓN | Una vez finalizado este proceso de estabilización, el paciente debe ser revisado nuevamente y cuidadosamente se debe determinar la posibilidad o no de lesiones coexistentes. Se debe proteger al paciente de la hipotermia |
*1 Sospecharemos un aumento de la PIC ante el deterioro neurológico con caída del Glasgow en 2 puntos durante el transporte o en el área (sugiere hernia cerebral en progreso), o presencia de signos de herniación en la valoración primaria o secundaria (asimetría pupilar mayor de 1mm, pupilas dilatadas no reactivas, o postura de descerebración).
*2 La hipotensión puede deberse a causas intracraneales (scalp extenso, hematoma subgaleal o extradural en un niño, fracturas compuestas que incluyan la bóveda o la base del cráneo) o extracraneales (lesión medular asociada, shock séptico, shock hipovolémico por hemorragia o traumatismo torácico asociado que pueda implicar taponamiento cardiaco, hemotórax o neumotórax a tensión).
NEUROMONITORIZACIÓN
La PIC elevada es responsable de la mayoría de lesiones secundarias derivadas de un TCE y por tanto un factor fundamental a la hora de determinar el pronóstico del mismo. La monitorización de los valores de PIC mediante diversos dispositivos, en su mayoría invasivos, se usa de forma rutinaria en el manejo del paciente con TCE grave como herramienta para dirigir el tratamiento.
En la práctica habitual se considera ideal mantener una PIC < 20 mmHg y por encima de 22 mmHg debe ser tratada activamente.
Indicaciones para la neuromonitorización invasiva del paciente con TCE:
- Paciente con TCE grave (GCS 3-8 tras reanimación) y TC craneal anormal. Se entiende por TC anormal la presencia de hematomas, swelling, contusiones, herniación o compresión de cisternas basales.
- Paciente con TCE grave (GCS 3-8 tras reanimación) y TC craneal normal sin cumple dos de los siguientes criterios: edad mayor de 40 años, respuesta motora anómala uni o bilateral, TAS < 90 mmHg.
La información obtenida de la monitorización de la PIC debe utilizarse como objetivo de tratamiento del paciente con TCE grave para reducir la mortalidad intrahospitalaria y a 2 semanas del traumatismo (nivel de recomendación IIB).
Como norma general se debe retirar el sistema de neuromonitorización si se obtienen cifras de PIC normales tras 48-72 horas de la retirada de las medidas terapéuticas encaminadas a su control.
TRATAMIENTO QUIRÚRGICO DEL TCE GRAVE
La cirugía del TCE grave puede dividirse en dos grandes grupos:
- Cirugía evacuadora: tiene como objetivo la evacuación de lesiones hemorrágicas con efecto masa significativo que produzcan herniación de estructuras y/o desviación de línea media.
- Cirugía descompresiva: Se encuadra entre las medidas de tratamiento de la PIC consideradas de “segundo nivel”, aunque sus indicaciones siguen siendo controvertidas por las importantes secuelas que conlleva a nivel funcional. Su principal indicación es en aquellos pacientes con TCE grave y cifras de PIC persistentemente elevadas a pesar del tratamiento médico.
BIBLIOGRAFÍA
- Ortega Zufiría JM, Lomillos Prieto N, Choque Cuba B, Tamarit Degenhardt M, Poveda Nuñez P, López Serrano MR. Traumatismo craneoencefálico leve. Surg Neurol Int. 2018; 9(Suppl 1): S16-S28. Disponible en: http://surgicalneurologyint.com/surgicalint-articles/traumatismo-craneoencefalico- leve/.
- American College of surgeons. Soporte Vital Avanzado en Trauma (ATLS), manual del curso para estudiantes. Novena edición. Chicago. 2012. Greg Johnson/Textbook perfect.
- Haddad S, Arabi Y. Clinical care management of severe traumatic brain injury in adults. Scand J Trauma Resusc Emerg Med. 2012; 20:12. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3298793/pdf/1757-7241-20-12.pdf.
- María Angustias Ibañez Pérez de la Blanca. Factores de rieso de lesiones intracraneales en mayores de 60 años con traumatismo craneoencefálico leve. Primera edición. Granada. Universidad de Granda. Tesis Doctorales.
- Ertmer C, Van Aken H. Fluid therapy in patients with brain injury: what does physiology tell us?. Crit Care. 2014, 18(2):119. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4057465/pdf/cc13764.pdf
- García-Lira JR, Zapata-Vázquez RE, Alonzo-Vázquez F, Rodriguez-Ruz SG, Medina- Moreno MR y Torres-Escalante JL. Rev Chil Pediatr. 2016; 87 (5): 387-394.
- Guidelines for the Management of Severe Traumatic Brain Injury, 4th Edition.
- Akopian G, Gaspard DJ, Alexander M. Outcomes of blunt head trauma without intracranial pressure monitoring. Am Surg 2007;73:447-450
- Idris Z, Ghani RI, Musa KI, et al. Prognostic study of using different monitoring modalities in treating severe traumatic brain injury. Asian J Surg 2007;30(3):200- 208.
- Eberle BM, Schnuriger B, Inaba K, Gruen JP, Demetriades D, Belzberg H. Decompressive craniectomy: surgical control of traumatic intracranial hypertension may improve outcome. Injury 2010;41(9):894-8.
- Cooper DJ, Rosenfeld JV, et al. Decompressive craniectomy in diffuse traumatic brain injury. N Engl J Med. 2011
- Jiang JY, Xu W, Li WP, et al. Efficacy of standard trauma craniectomy for refractory intracranial hypertension with severe traumatic brain injury: a multicenter, prospective, randomized controlled study. J Neurotrauma. 2005
- Qiu W, Guo C, Shen H, et al. Effects of unilateral decompressive craniectomy on patients with unilateral acute post-traumatic brain swelling after severe traumatic brain injury. Crit Care. 2009.
- P.J. Hutchinson, A.G. Kolias, et al. Trial of Decompressive Craniectomy for Traumatic Intracranial Hypertension. N Engl J Med. 2016