Romero López, Cristina
García Rubio, Rosa María
González Pombo, Marta
INTRODUCCIÓN
La hemorragia subaracnoidea (HSA) espontánea consiste en la presencia de sangre en el espacio subaracnoideo de etiología no traumática.
La incidencia anual estimada en nuestro medio se encuentra entre 7 y 10 casos por cada 100.000 individuos; es máxima en individuos entre los 50 y los 60 años, con una discreta predilección por el sexo femenino.
Sus principales factores de riesgo son: historia familiar de HSA o aneurisma, HTA, hábito tabáquico y consumo excesivo de alcohol. Hasta un 15% de los pacientes que sufren una HSA fallecen antes de recibir asistencia médica, un 25% lo hacen en las primeras 24 horas de evolución y la mortalidad a los 30 días alcanza el 43-44%.
El principal factor pronóstico es el grado de severidad clínica inicial.
La causa más frecuente es la rotura de un aneurisma intracraneal (75-80%). Otras etiologías: malformación arteriovenosa cerebral (4-5%), vasculitis infecciosa o autoinmune, discrasias sanguíneas y HSA perimesencefálica no aneurismática.
Es importante tener en cuenta que los pacientes con HSA espontánea también pueden sufrir traumatismos craneoencefálicos en el contexto de síncope o deterioro del nivel de conciencia.
Es fundamental una adecuada anamnesis del paciente y/o los acompañantes para determinar las circunstancias del traumatismo y orientar adecuadamente las pruebas diagnósticas.
CLÍNICA Y DIAGNÓSTICO
| CLÍNICA | DIAGNÓSTICO |
| Síntomas y signos:
Sospechar HSA espontánea en todo paciente con cefalea que se acompañe de al menos uno de los siguientes signos de alarma: • Inicio brusco con elevada intensidad • Cambios en las características de una cefalea ya conocida. • Interrupción del sueño. • Náuseas y vómitos (77%). • Pérdida de conocimiento (53%). • Meningismo (35%). • Crisis epiléptica (20%). • Focalidad neurológica. • Fotofobia y sonofobia.
Complicaciones: • Resangrado: Es la principal causa de muerte en las primeras 72 horas de evolución, afectando de media a un 13% de los pacientes. El clipaje o embolización del aneurisma roto debe realizarse tan pronto como sea posible para reducir esta complicación (recomendación clase I, nivel B). • Vasoespasmo: Puede aparecer radiológica y/o sonográficamente desde el inicio de los síntomas, aunque su manifestación clínica rara vez se presenta antes de las 72 horas de evolución. Alcanza su máxima incidencias entre el 6º y 14º días. • Hidrocefalia aguda: En aprox. 20% de los pacientes. • Síndrome pierde sal cerebral.
|
TC craneal sin contraste: Sensibilidad del 100% en las primeras 6 horas desde el inicio de los síntomas (recomendación clase II, nivel B). Además, permite:
• Valorar tamaño ventricular. • Predecir localización del aneurisma en función del patrón de distribución del sangrado. • Estimar riesgo de vasoespasmo (escala de Fisher).
Punción lumbar: Si alto grado de sospecha clínica y TC SIN presencia de HSA. (recomendación clase II, nivel B)
AngioTC craneal: Ante HSA con patrón aneurismático en TC sin contraste, se debe completar el estudio con angio-TC de cráneo, si no existe contraindicación formal para la administración de contrastes yodados (recomendación clase II, nivel B). Es recomendable que esta prueba se realice antes de que el paciente abandone la sala de radio-diagnóstico para reducir el tiempo de actuación.
Analítica sanguínea con bioquímica, hemograma, coagulación y tipaje.
Pruebas a criterio de Neurocirugía: • Arteriografía cerebral: Sigue siendo el gold standard en el diagnóstico de la HSA no traumática. Es especialmente relevante su sensibilidad para la detección de aneurismas < 3 mm adyacentes a estructuras óseas (microaneurismas del complejo comunicante anterior), con frecuencia difíciles de identificar en el angio-TC. Está indicado realizar angiografía 3D a todos los pacientes con HSA aneurismática para detección del aneurisma (excepto cuando éste haya sido previamente identificado de forma concluyente mediante angio-TC) y para planificación del tratamiento (recomendación clase I, nivel B).
|
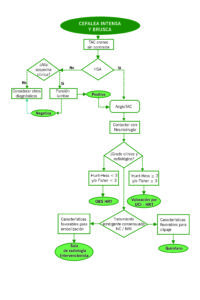
ALGORITMO DE MANEJO
*Medidas iniciales:
- Toma de constantes y monitorización básica (TA, FC, SpO2, temperatura).
- Evaluación de la Glasgow Coma Scale.
- Exploración neurológica básica: signos de meningismo, pares craneales, lenguaje, balance motor y sensitivo.
- Canalización de vía periférica y administración de analgesia intravenosa.
- En caso de emergencia hipertensiva, iniciar tratamiento de la misma con bolo lento de 20 mg de Labetalol IV o con U rapidilo IV en bolo de 12’5 mg.
**Candidatos favorables a tratamiento quirúrgico (clipaje del aneurisma):
- Pacientes jóvenes.
- Pacientes con hematoma intraparenquimatoso asociado que requiera evacuación quirúrgica (recomendación clase II, nivel B). En casos seleccionados podría realizarse embolización del aneurisma y posterior cirugía de evacuación del hematoma.
- Pacientes con aneurismas que presenten características favorables para su clipaje quirúrgico: aneurismas localizados en ACM (recomendación clase III, nivel B); aneurismas de arteria pericallosa (recomendación clase III, nivel B); aneurismas con cuello ancho (recomendación clase III, nivel B) y presencia de ramas arteriales con origen en el saco aneurismático (recomendación clase III, nivel B).
***Candidatos favorables a tratamiento endovascular (embolización del aneurisma):
- Pacientes de edad >70 años (recomendación clase II, nivel B).
- Ausencia de hematoma intraparenquimatoso que requiera evacuación quirúrgica EMERGENTE (recomendación clase II, nivel B).
- Pacientes con aneurismas que presenten características favorables para su embolización: aneurismas de circulación posterior (arterias vertebrales, PICA, AICA, top de la arteria basilar); aneurismas de cuello estrecho y forma sacular (recomendación clase III, nivel B).
De cualquier modo, siempre habrá que individualizar en cada caso según las características clínicas del paciente, las características morfológicas de la lesión responsable y la disponibilidad en caso de precisar tratamiento emergente.
****Escalas:
Escala de severidad clínica Hunt – Hess y mortalidad asociada
| GRADO | DESCRIPCIÓN | MORTALIDAD |
| 1 | Asintomático o cefalea leve. | 1-6% |
| 2 | Afectación de par craneal, cefalea moderada o severa, rigidez de nuca. | 1-8% |
| 3 | Focalidad neurológica leve (excepto par craneal), confusión, tendencia al sueño. | 15-20% |
| 4 | Bajo nivel de conciencia, hemiparesia moderada o severa. | 30-50% |
| 5 | Coma, rigidez de descerebración. | 50-90% |
Escala radiológica de Fisher: riesgo de aparición de vasoespasmo
| GRADO | DESCRIPCIÓN | MORTALIDAD |
| 1 | No se identifica sangre en espacio subaracnoideo | 21% |
| 2 | Sangrado difuso de grosor <1 mm | 25% |
| 3 | Coágulos en cisternas, grosor >1 mm | 37% |
| 4 | Hematoma intraparenquimatoso y/o intraventricular | 31% |
TRATAMIENTO EN OBSERVACIÓN
Medidas generales:
- Ubicación del paciente en observación HRT.
- Reposo en cama con cabecero a 30º.
- Monitorización básica: EKG continuo, FC, SpO2, TA horaria, temperatura horaria.
- Vigilancia neurológica estrecha: reactividad pupilar y GCS cada hora.
- Dieta absoluta.
- Sondaje urinario y control de diuresis por turnos.
- Solicitar analítica con hemograma completo, bioquímica básica, estudio de coagulación y tipaje.
Medidas específicas:
- Analgesia intravenosa. Se utilizarán preferentemente Paracetamol, Metamizol, cloruro mórfico o fentanilo, salvo alergia o contraindicación formal. Se evitarán AINEs.
- Sueroterapia con suero salino fisiológico 2000 mL/día. Se realizarán las correcciones de volumen oportunas en aquellos pacientes con patología cardiaca o renal que requieran restricción de volumen.
- Protección gástrica con IBP (Omeprazol, Pantoprazol) vía intravenosa.
- Antieméticos y laxantes: se prescribirán antieméticos y laxantes a demanda para evitar el aumento de PIC asociado a maniobras de Valsalva.
- Nimodipino 60 mg cada 4 horas vía oral en todos los pacientes cuyo nivel de conciencia permita la ingesta, a pesar de la orden de dieta absoluta. Se administrará por vía intravenosa únicamente en aquellos pacientes en los que no esté disponible la vía oral. Antes de cada administración se comprobará la TA del paciente; no se administrará la dosis correspondiente si la cifra de TAS es menor de 100 mmHg. Se suspenderá el tratamiento de forma definitiva una vez completado el periodo de riesgo de vasoespasmo.
- Suspensión inmediata de medicación antiagregante o anticoagulante. En aquellos pacientes que realicen tratamiento con anticoagulantes orales (Dabigatrán, Apixabán, Ribaroxabán, Aldocumar, Acenocumarol) se procederá a la reversión de su efecto, si procede.
- Control de cifras de tensión arterial. Desde el momento del diagnóstico y hasta el tratamiento definitivo del aneurisma es tan importante asegurar una adecuada presión de perfusión cerebral evitando la hipotensión como reducir el riesgo de resangrado que conlleva la hipertensión (recomendación clase I, nivel B). No existen evidencia científica establecida sobre las cifras ideales de TA que se deben marcar como objetivo en estos pacientes, pero se recomienda mantener TAS por debajo de 160 mmHg (recomendación clase IIa, nivel C).
- Antiepilépticos: se iniciará tratamiento con Levetiracetam 500 mg cada 12 horas en aquellos pacientes que hayan presentado crisis comiciales. No existe evidencia científica que apoye el uso de antiepilépticos de forma profiláctica (recomendación clase IV, nivel C).
- Corticoides: no existe evidencia científica que apoye el uso de corticoides en pacientes con HSA (recomendación clase IV, nivel C).
- Prevención de TVP: se iniciará profilaxis antitrombótica en aquellos pacientes de alto riesgo con medidas físicas. En todo caso, el inicio de HBPM debe postponerse hasta que se haya tratado el aneurisma (recomendación clase II, nivel B).
CRITERIOS DE INGRESO
Una vez establecido el diagnóstico de HSA no traumática el paciente será valorado de forma conjunta por el facultativo de urgencias, neurocirugía, neurorradiología intervencionista y cuidados intensivos (si procede) para decidir su ubicación final:
- Valoración por Cuidados Intensivos para ingreso a su cargo, especialmente aquellos pacientes con datos de gravedad mencionados anteriormente (Hunt-Hess ≥ 3 y/o Fisher ≥ 3).
- En caso de no tener criterio de ingreso en UCI, paso a Observación para vigilancia neurológica estrecha y tratamiento sintomático +/- completar estudio diagnóstico o en espera de decisión terapéutica.
- Traslado a quirófano si indicación de tratamiento quirúrgico urgente.
- Traslado a sala de arteriografía para completar estudio y/o realizar tratamiento endovascular. Si se realiza tratamiento endovascular el paciente, en lugar de volver a Observación, pasará a la Unidad de Recuperación Postanestésica entre 24-48 horas para vigilancia neurológica y monitorización de constantes.
BIBLIOGRAFÍA
- Macdonald RL, Schweizer TA. Spontaneous subarachnoid haemorrhage. Lancet (London, England). 2017 Feb 11;389(10069):655–66.
- Carpenter CR, Hussain AM, Ward MJ, Zipfel GJ, Fowler S, Pines JM, et al. Spontaneous Subarachnoid Hemorrhage: A Systematic Review and Meta-analysis Describing the Diagnostic Accuracy of History, Physical Examination, Imaging, and Lumbar Puncture With an Exploration of Test Thresholds. Zehtabchi S, editor. Acad Emerg Med. 2016 Sep;23(9):963–1003.
- Connolly ES, Rabinstein AA, Carhuapoma JR, Derdeyn CP, Dion J, Higashida RT, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/american Stroke Association. Stroke. 2012 Jun 1;43(6):1711–37.
- Molyneux AJ, Kerr RS, Yu L-M, Clarke M, Sneade M, Yarnold JA, et al. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet. 2005 Sep;366(9488):809–17.
- Steiner T, Juvela S, Unterberg A, Jung C, Forsting M, Rinkel G, et al. European Stroke Organization Guidelines for the Management of Intracranial Aneurysms and Subarachnoid Haemorrhage. Cerebrovasc Dis. 2013;35(2):93–112.
- Long B, Koyfman A, Runyon MS. Subarachnoid Hemorrhage. Emerg Med Clin North Am. 2017 Nov;35(4):803–24.
- SAH and aneurysms. En: Greenberg, M.S. Handbook of Neurosurgery, 7th edition. USA: Thieme Publishers; 2010. p. 1034–1096.
- Naval NS, Kowalski RG, Chang TR, Caserta F, Carhuapoma JR, Tamargo RJ. The SAH Score: a comprehensive communication tool. J Stroke Cerebrovasc Dis. 2014 May-Jun;23(5):902–9.
- Hunt W.E., Hess R.M. Surgical risk as related to time of intervention in the repair of intracranial aneurysms. J Neurosurg. 1968; 28:14–20.
- Report of World Federation of Neurological Surgeons Committee on a Universal Subarachnoid Hemorrhage Grading Scale. J Neurosurg. 1988; 68:985–986.
- Naval, Neeraj S. et al. The SAH Score: A Comprehensive Communication Tool Journal of Stroke and Cerebrovascular Diseases, Volume 23, Issue 5, 902–90912.
- Maher, M., Schweizer, T. A., Macdonald, R. L. Treatment of Spontaneous Subarachnoid Hemorrhage. Stroke. 2020;51:00–00.