Álvarez Vallejo, Beatriz
Escudero Ávila, Rocío
Neth, Olaf
Las “terapias biológicas” constituyen en la actualidad uno de los pilares fundamentales para el manejo eficaz de una gran variedad de enfermedades autoinmunes e inflamatorias, con un uso cada más extendido en pediatría. Además, estos agentes se utilizan frecuentemente en combinación con otros fármacos inmunosupresores, como el metotrexato o los corticoides.
Sin embargo, existe un riesgo aumentado de infecciones oportunistas asociadas a la administración de tratamientos inmunomoduladores, principalmente infecciones por patógenos intracelulares como Mycobacterium tuberculosis y fúngicas.
Hay que tener en cuenta que el efecto inmunosupresor puede persistir días o semanas después de la interrupción del tratamiento inmunomodulador.
En la siguiente tabla se resumen los puntos más importantes a la hora de realizar la historia clínica de pacientes con tratamiento inmunosupresor.
| ANAMNESIS | ANTECEDENTES PERSONALES | – Estado vacunal.
– Alergias medicamentosas. – Viajes recientes, salidas al campo, ingesta de alimentos fuera de la dieta habitual… |
| CONTROL DE LA ENFERMEDAD | – Enfermedad de base.
– Tiempo de evolución. – Grado de control actual de la enfermedad. |
|
| ÚLTIMA REVISIÓN EN CONSULTA | – Revisar último informe de consulta (estado en última visita, resultado de pruebas complementarias, plan de actuación…). | |
| TRATAMIENTO ACTUAL | – Fármaco/s, dosis, interacciones medicamentosas. | |
| ADHERENCIA TERAPÉUTICA | – Preguntar sobre adecuado cumplimiento del tratamiento. | |
| PROCESOS INTERCURRENTES | – Cuadros infecciosos o de otra naturaleza que coinciden con el proceso actual. | |
| ENFERMEDAD ACTUAL | – Cronología del proceso actual.
– Desencadenantes. – Sintomatología actual. – Tolerancia de la medicación. |
|
| EXPLORACIÓN FÍSICA | Completa. Especial atención a:
– ACP – ORL – Adenopatías – Hepatoesplenomegalia – Lesiones cutáneas |
|
A continuación, se resumen los principales fármacos inmunosupresores utilizados en Pediatría, su mecanismo de acción y efecto en el sistema inmune y la susceptibilidad que generan a determinadas infecciones.
| FÁRMACO | MECANISMO DE ACCIÓN/
EFECTO EN EL SISTEMA INMUNE |
SUSCEPTIBILIDAD
INFECCIÓN |
SUSCEPTIBILIDAD PATÓGENO | OBSERVACIONES | RIESGO INFECCIÓN VHB/VVZ/
TBC |
| Corticoides | – Linfopenia
–Disminución síntesis Ig – Disminución citoquinas proinflamatorias (IL-2, IL-4, IL-6, TNF, interferón γ, etc.) |
En función de la dosis | Bacterias: Salmonella spp, L. monocytogenes, nocardia, M. tuberculosis.
Virus: HSV, VVZ. Hongos:P. jirovecii, Candida spp., micosis endémica. Parásitos: S. stercoralis. |
Se consideran dosis altas (alto riesgo de infección):
2 mg/kg/día o >20 mg/día durante más de 14 días |
|
| FAME
– Tiopurinas (Azatioprina) – Ciclosporina – Metotrexato |
– Linfopenia
– Neutropenia |
Desconocido | No gérmenes específicos (descritas infecciones por P. jirovecii) | ||
| Anti TNFα:
Infliximab Adalimumab Etanercept
|
Alteración respuesta inmune adaptativa:
– Formación de granulomas – Activación de macrófagos – Respuesta inmune viral |
Leve | M. tuberculosis, Listeria monocytogenes,histoplasmosis y P. jirovecii. | Hacer despistaje TBC previo inicio tratamiento.
Menos riesgo con etarnercept Contraindicadas vacunas virus vivos durante el tratamiento. |
VHB/VVZ/TBC |
| Anti IL-1 β:
Anakinra Canakimumab Rilonacept |
– Inhibe resorción ósea y daño al cartílago
– Neutropenia Inhibición de producción de citoquinas pro-inflamatorias (Il-6, TNFα) |
Moderado | Celulitis, neumonía (S. pneumoniae), infecciones por micobacterias | Hacer despistaje TBC previo inicio tratamiento.
|
Incierto (cierto riesgo de progresión de TBC latente) |
| Anti IL-6:
Tocilizumab Siltuximab |
Inhibe la secreción Ig, activación linf T y fibroblastos sinoviales
Posible neutropenia |
Moderado | Similar a anti TNFα
S. aureus, E. coli, Streptococcus spp, Cándida spp |
Hacer despistaje TBC previo inicio tratamiento | VHB/VVZ/TBC |
| Anti IL-12/23 p40: Ustekinumab
|
Inhibe la activación de NK y activación y diferenciación Linf T CD4
|
Leve | No gérmenes específicos | Reactivación TBC, infección crónica VHB | |
| Anti IL-17:
Secukinumab |
Inhibe la liberación de citocinas y quimiocinas proinflamatorias. | Desconocido | Infecciones mucocutáneas por Cándida | Infección latente TB (bajo riesgo de progresión a TB activa)
|
NO |
| Anti IgE:
Omalizumab |
Limita el grado de liberación de mediadores de la respuesta alérgica (mastocitos y basófilos) | Mínimo | Riesgo de infección parasitaria | Despistaje de enfermedades parasitarias antes y durante el tratamiento si zona de riesgo | NO |
| Anti C5:
Eculizumab |
Inhibe formación del complejo C5b-9 del complemento à Impide formación de canales transmembrana que causan la lisis del eritrocito. | Grave (para infecciones por Neisseria) | Infección por Neisseria (enf meningocócia invasiva y enfermedad gonocócica diseminada)
Menor riesgo S. pneumoniae y H. influenzae |
Asegurar correcta inmunidad frente a meningococo antes y durante el tratamiento (quimioprofilaxis hasta conseguir vacunación completa) | NO |
| Anti CD20:
Rituximab (y otros) |
Eliminación de células B CD20+ facilitada por citotoxicidad dependiente de anticuerpos
Posible neutropenia e hipogammaglobulinemia |
Desconocido | P. jirovecii
Enterovirus
|
Cierto riesgo encefalopatía multifocal progresiva | Riesgo reactivación VHB (y VHC) y VVZ |
| Anti VEGF:
Bevavizumab |
Inhibe angiogénesis
Neutropenia |
Grave (secundario a neutropenia) | Riesgo perforación GI (con peritonitis y bacteriemia) | ||
| Anti PI3K:
Idelalisib |
Induce apoptosis e inhibe proliferación de líneas celulares derivadas de células B malignas y células de tumores primarios. | Grave | Infección fúngica invasiva, P. jirovecii, CMV | Riesgo hepatotoxicidad, colitis, neumonitis | NO |
| Anti JAK1/2:
Ruxolitinib |
Inhibe transducción de señales de varias citoquinas y factores de crecimiento que son importantes para la hematopoyesis y para la función inmune. | Grave | P. jirovecii, CMV, VEB, herpes zoster, infección fúngica invasiva | Riesgo encefalopatía multifocal progresiva | TBC y reactivación VHB |
| Anti mTOR:
Sirolimus |
Inhibe la activación de las células T mediante el bloqueo de la transducción de señales intracelulares dependientes e independientes de calcio. | Grave | Herpes zoster, P. jirovecii | TBC y reactivación VHB |
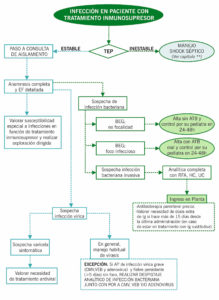
ALGORITMO DE MANEJO EN URGENCIAS
BIBLIOGRAFÍA
- Davis JS, Ferreira D, Paige E, Gedye C, Boyle M. Infectious Complications of Biological and Small Molecule Targeted Immunomodulatory Therapies. Clin Microbiol Rev. 2020 Jun 10;33(3):e00035-19. doi: 10.1128/CMR.00035-19. PMID: 32522746; PMCID: PMC7289788.
- Giancane G, Swart JF, Castagnola E, Groll AH, Horneff G, Huppertz HI, Lovell DJ, Wolfs T, Herlin T, Dolezalova P, Sanner H, Susic G, Sztajnbok F, Maritsi D, Constantin T, Vargova V, Sawhney S, Rygg M, K Oliveira S, Cattalini M, Bovis F, Bagnasco F, Pistorio A, Martini A, Wulffraat N, Ruperto N; Paediatric Rheumatology International Trials Organisation (PRINTO). Opportunistic infections in immunosuppressed patients with juvenile idiopathic arthritis: analysis by the Pharmachild Safety Adjudication Committee. Arthritis Res Ther. 2020 Apr 7;22(1):71. doi: 10.1186/s13075-020-02167-2. PMID: 32264969; PMCID: PMC7136994.
- Aeschlimann FA, Chong SL, Lyons TW, Beinvogl BC, Góez-Mogollón LM, Tan S, Laxer RM. Risk of Serious Infections Associated with Biologic Agents in Juvenile Idiopathic Arthritis: A Systematic Review and Meta-Analyses. J Pediatr. 2019 Jan;204:162-171.e3. doi: 10.1016/j.jpeds.2018.08.065. Epub 2018 Oct 11. PMID: 30318371.
- Baddley JW, Cantini F, Goletti D, Gómez-Reino JJ, Mylonakis E, San-Juan R, Fernández-Ruiz M, Torre-Cisneros J. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Soluble immune effector molecules [I]: anti-tumor necrosis factor-α agents). Clin Microbiol Infect. 2018 Jun;24 Suppl 2:S10-S20. doi: 10.1016/j.cmi.2017.12.025. Epub 2018 Feb 6. PMID: 29459143.
- Winthrop KL, Mariette X, Silva JT, Benamu E, Calabrese LH, Dumusc A, Smolen JS, Aguado JM, Fernández-Ruiz M. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Soluble immune effector molecules [II]: agents targeting interleukins, immunoglobulins and complement factors). Clin Microbiol Infect. 2018 Jun;24 Suppl 2:S21-S40. doi: 10.1016/j.cmi.2018.02.002. Epub 2018 Feb 12. PMID: 29447987.
- Mikulska M, Lanini S, Gudiol C, Drgona L, Ippolito G, Fernández-Ruiz M, Salzberger B. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Agents targeting lymphoid cells surface antigens [I]: CD19, CD20 and CD52). Clin Microbiol Infect. 2018 Jun;24 Suppl 2:S71-S82. doi: 10.1016/j.cmi.2018.02.003. Epub 2018 Feb 12. PMID: 29447988.
- Reinwald M, Silva JT, Mueller NJ, Fortún J, Garzoni C, de Fijter JW, Fernández-Ruiz M, Grossi P, Aguado JM. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Intracellular signaling pathways: tyrosine kinase and mTOR inhibitors). Clin Microbiol Infect. 2018 Jun;24 Suppl 2:S53-S70. doi: 10.1016/j.cmi.2018.02.009. Epub 2018 Feb 16. PMID: 29454849.
- Aguilar-Company J, Fernández-Ruiz M, García-Campelo R, Garrido-Castro AC, Ruiz-Camps I. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Cell surface receptors and associated signaling pathways). Clin Microbiol Infect. 2018 Jun;24 Suppl 2:S41-S52. doi: 10.1016/j.cmi.2017.12.027. Epub 2018 Feb 7. PMID: 29426804.
- Redelman-Sidi G, Michielin O, Cervera C, Ribi C, Aguado JM, Fernández-Ruiz M, Manuel O. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Immune checkpoint inhibitors, cell adhesion inhibitors, sphingosine-1-phosphate receptor modulators and proteasome inhibitors). Clin Microbiol Infect. 2018 Jun;24 Suppl 2(Suppl 2):S95-S107. doi: 10.1016/j.cmi.2018.01.030. Epub 2018 Feb 7. PMID: 29427804; PMCID: PMC5971148.