Fillal Kilch, Soumia
Ramírez Villar, Gema Lucía
CISTITIS HEMORRÁGICA
Cistitis estéril de causa no infecciosa, caracterizada por hematuria franca asociada a síntomas de irritación del tracto urinario inferior. Primera causa de hematuria en el paciente oncológico. Más frecuente en pacientes tratados con ifosfamida (IFO) o altas dosis de ciclofosfamida (CFM), en los que reciben irradiación pélvica y en niños sometidos a trasplante de progenitores hematopoyéticos (TPH).
| CLÍNICA | DIAGNÓSTICO |
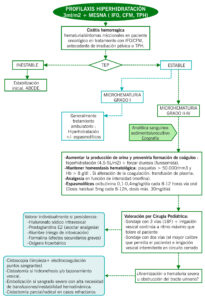
| Suele aparecer 24-48 horas tras quimioterapia, aunque puede ser más tardía (semanas, meses e incluso años si radioterapia). Clasificación de síntomas según grados de Droller et al:
– Grado I: hematuria microscópica + síntomas irritativos leves – Grado II: hematuria macroscópica+ empeoramiento de los síntomas miccionales/incontinencia – Grado III: hematuria macroscópica con aparición de coágulos +dolor suprapúbico y síndrome hemorrágico controlado – Grado IV: hematuria masiva y obstrucción del tracto urinario por coágulos + afectación del estado general y trastornos de la hemostasia. |
Principalmente clínico:
– Anamnesis: hematuria/síntomas miccionales en paciente oncológico en tratamiento con quimioterapia o antecedente de irradiación pélvica o sometido a TPH. Presencia de coágulos visibles en orina, dolor y dificultad en expulsión de los mismos. – Exploración física: presencia abdomen distendido con/sin globo vesical a la palpación, puñopercusión renal dolorosa, presencia de renomegalia palpable. Monitorización de constantes (tensión arterial, frecuencia cardíaca). ¡Control estricto de diuresis! – Pruebas complementarias: o Analítica sanguínea con hemograma, bioquímica, coagulación y PCR virus (BK/JC, CMV y adenovirus). o Sedimento y urocultivo (virus en orina). o Ecografía abdominal / TC / RM o Citoscopia: en casos graves. |
ALGORITMO
TROMBOSIS TUMORAL DEL WILMS
El tumor de Wilms es el tumor renal más frecuente en la infancia y segundo tumor sólido abdominal más frecuente en población pediátrica. La extensión tumoral hacia los vasos se produce en aproximadamente un 11% de los pacientes, generalmente afectando a la vena renal, aunque puede afectar también a la vena cava y llegar incluso hasta cavidades cardiacas. La evaluación tanto al diagnóstico como en el estudio preoperatorio del tumor es crucial para valoración del grado de invasión intravascular.
| CLÍNICA Y DIAGNÓSTICO | TRATAMIENTO |
| Clínica: gran mayoría asintomático.
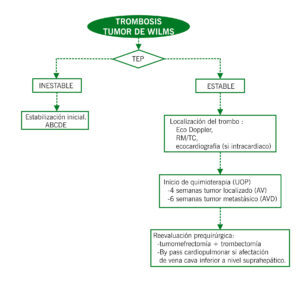
Un porcentaje inferior al 30% presentan síntomas entre los que destacan: – Varicocele (más frecuente en varones <10 años). – Edema extremidades inferiores. – Embolia pulmonar (si el trombo alcanza la aurícula derecha). – Circulación colateral en la pared abdominal. – Proteinuria. Diagnóstico: suele ser por pruebas de imagen que se realizan al diagnóstico – Ecografía abdominal Doppler – RM o TC con contraste – Ecocardiografía si sospecha de localización cardíaca. |
– Inicio de quimioterapia:
Según protocolo de la SIOP (UMBRELLA2016) : o Si enfermedad localizada à4 semanas de tratamiento quimioterápico (Vincristina/Actinomicina) o Si enfermedad metastásica à6 semanas de tratamiento quimioterápico (Vincristina/Actinomicina/Doxorrubicina) – Con la quimioterapia se consigue reducción del tamaño tumoral y del trombo facilitando el abordaje quirúrgico posterior. – El pronóstico del tumor de Wilms no se modifica por la presencia de un trombo tumoral, éste depende exclusivamente del grado histológico y del estadio. – La heparina de bajo peso molecular parece tener un efecto beneficioso, aunque a día de hoy no existen estudios que avalen su uso de forma rutinaria. |
ALGORITMO
BIBLIOGRAFÍA
- Gander R, Asensio M, Guillén G, Royo GF, Bolaños A, Pérez M, Diaz-De-Heredia C, Benitez M, López M. Hemorrhagic cystitis after hematopoietic stem cell transplantation: A challenge for the pediatric urologist. J Pediatr Urol. 2018 Oct;14(5):366-373.
- Hassan Z. Management of refractory hemorrhagic cystitis following hematopoietic stem cell transplantation in children. Pediatr Transplant. 2011 Jun;15(4):348-61.
- Decker DB, Karam JA, Wilcox DT. Pediatric hemorrhagic cystitis. J Pediatr Urol 2009: 5: 254–264
- Gónzalez Rodríguez JD, Canalejo González D, Caraballo Pérez A, Martin-Niclós Govantes JJ. Cistitis hemorrágica. En: Márquez Vega C, Ramírez Villar G. Manuel de urgencias de oncología pediátrica. Grupo Acción Médica; 2006. p 63-64.
- Morris L, Squire R, Sznajder B, van Tinteren H, Godzinski J, Powis M. Optimal neoadjuvant chemotherapy duration in Wilms tumour with intravascular thrombus: A literature review and evidence from SIOP WT 2001 trial. Pediatr Blood Cancer. 2019 Nov;66(11):e27930.
- Khanna G, Rosen N, Anderson JR, Ehrlich PF, Dome JS, Gow KW, Perlman E, Barnhart D, Karolczuk K, Grundy P.Evaluation of diagnostic performance of CT for detection of tumor thrombus in children with Wilms tumor: a report from the Children’s Oncology Group. Pediatr Blood Cancer. 2012 Apr;58(4):551-5.
- Aspiazu D, Fernandez-Pineda I, Cabello R, Ramirez G, Alvarez-Madrid A, De Agustin JC. Surgical management of Wilms tumor with intravascular extension: a single-institution experience. Pediatr Hematol Oncol. 2012 Feb;29(1):50-4.
- Van den Heuvel-Eibrink MM, Hol JA, Pritchard-Jones K, van Tinteren H, Furtwängler R, Verschuur AC, Vujanic GM, Leuschner I, Brok J, Rübe C, Smets AM, Janssens GO, Godzinski J, Ramírez-Villar GL, de Camargo B, Segers H, Collini P, Gessler M, Bergeron C, Spreafico F, Graf N; International Society of Paediatric Oncology — Renal Tumour Study Group (SIOP–RTSG). Position paper: Rationale for the treatment of Wilms tumour in the UMBRELLA SIOP-RTSG 2016 protocol. Nat Rev Urol. 2017 Dec;14(12):743-752.